Il documento chiarisce la differenza fra dispositivi su misura, dispositivi adattabili e dispositivi paziente-specifici per una corretta definizione e un puntuale inquadramento degli stessi da parte dei fabbricanti. Particolare attenzione è rivolta ai dispositivi medici realizzati mediante metodiche di stampa 3D. Il 26 settembre 2019 il Medical Device Coordination Group (MDCG) ha rilasciato alcune indicazioni su questa sintesi. Quando il regolamento UE dispositivi medici (MDR, Medical Device Regulation) entrerà in vigore a maggio 2021, il documento SSCP diventerà obbligatorio per alcuni dispositivi a medio e alto rischio, tra cui i dispositivi impiantabili di classe IIa/IIb e i dispositivi di classe III. Qualora l’utente desideri non fornire il proprio consenso all’utilizzo dei dati per finalità di Marketing, potrà inviare una semplice richiesta alla Società (vedere il punto 12) di seguito indicato o selezionando l’apposito link sulla mail ricevuta. In caso di operazioni patrimoniali o societarie (ad esempio, fusioni o acquisizioni, ristrutturazioni aziendali o liquidazione), i dati dei clienti saranno probabilmente uno dei beni ceduti e potranno essere condivisi con i successori legali, nella misura consentita dalla legge sulla base del legittimo interesse della Società.
Strategie linguistiche basate sull'intelligenza artificiale e servizi di traduzione per dispositivi medicali
Il rispetto delle stesse condizioni è richiesto per tutte le tecniche di procreazione medicalmente assistita (per esempio, inseminazione, fecondazione in vitro, eccetera). Le spese per le prestazioni di luce pulsata sono detraibili quando effettuate per sopperire ai danni estetici provocati dall’irsutismo. Per semplificare gli adempimenti fiscali a carico dei contribuenti, le spese sostenute per queste prestazioni sono detraibili anche in assenza di una specifica prescrizione medica.
- Stimolati dai progressi della tecnologia medica, negli ospedali di tutto il mondo si utilizzano sempre più spesso dispositivi medici all’avanguardia.
- Invece accelerano a doppia cifra quelli contro il settore ICT (+53%) e le infrastrutture critiche (+54%).
- Per garantire un utilizzo corretto della strumentazione medicali, i manuali operativi devono risultare affidabili e perfettamente comprensibili in tutte le lingue in cui sono tradotti.
- Se hai una webcam ci potremo anche vedere con Skype o altro strumento di videoconferenza, così non saremo solo una voce o una mail.
- In caso di cessazione dell’attività è necessario inviare, entro 30 giorni, comunicazione al Ministero della salute all’indirizzo di posta elettronica certificata (PEC)
Quali sono i requisiti per una traduzione di dispositivi medici?
I dati personali rimarranno soggetti all’informativa sulla privacy preesistente, salvo laddove l’utente decida diversamente. Qualora l’utente fornisca alla Società dati personali di terzi (ad esempio, familiari, altri clienti o potenziali clienti), lo stesso dovrebbe accertarsi che tali soggetti terzi siano informati e abbiano autorizzato l’utilizzo dei loro dati come descritto nella presente Informativa sulla Privacy. L’articolo 16 però non richiama le procedure di valutazione della conformità di cui all’articolo 52 MDR (né l’articolo 16 del IVDR richiama l’articolo 48 del regolamento stesso). Si è posto quindi da subito un duplice problema per distributori ed importatori quello di stabilire i requisiti del Sgq da implementare; per gli Nb quello invece di determinare le attività di valutazione necessarie per certificare tale SGQ. Con il varo dei nuovi meccanismi e l’uniformazione del sistema diventerà molto più semplice monitorare lo stato dei dispositivi medici in Europa, migliorarne le prestazioni e rispondere più velocemente alle nuove richieste provenienti dal mercato. Strumento prezioso e funzionale al fine sopra esposto è EUDAMED, la banca dati tramite cui sarà possibile seguire l’intero ciclo di vita del dispositivo medico.
Servizi professionali di traduzione e interpretariato
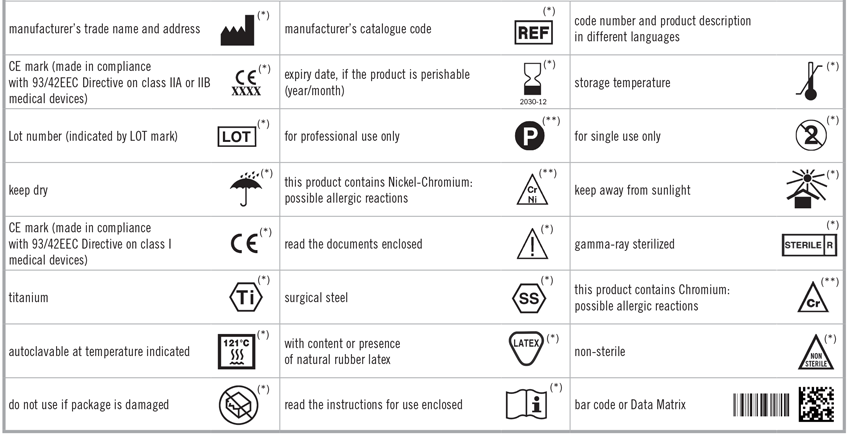 È importante tenere in considerazione che il documento SSCP master può venire accettato in una lingua dell'UE diversa dall'inglese, a seconda degli Stati membri dell'Unione Europea in cui il dispositivo verrà venduto. In questo caso, sarà obbligatorio fornire la versione inglese entro 90 giorni dal caricamento del master nella banca dati Eudamed da parte dell'organismo notificato. In linea con la normativa GDPR, Interbrian vuole garantire che ogni utente del sito web comprenda cosa sono i cookie e per quale motivo vengono utilizzati, in modo che possa decidere consapevolmente se accettarne l’utilizzo o no. Un cookie è un piccolo file di testo contenente un numero di identificazione univoco che viene trasferito dal sito web sul disco rigido del computer attraverso un codice anonimo in grado di identificare il computer ma non l’utente e di monitorare passivamente le attività sul sito. I dati personali dell’utente che sono oggetto di trattamento per finalità di marketing (punto 3.2) saranno conservati fino fino a quando non sarà ritirato il consenso al loro trattamento per tali finalità. L’utente potrà aggiornare i dati forniti alla Società contattando la stessa all’indirizzo fornito qui di seguito.
Una traduzione di qualità per dispositivi medici non richiede solo conoscenze linguistiche e competenze tecniche. https://torp-lorentsen.hubstack.net/qual-e-il-livello-piu-alto-di-inglese-e-come-raggiungerlo-1727483350 settore dei dispositivi medici, infatti, è un'industria altamente regolamentata e i servizi di traduzione linguistica devono attenersi alle rigorose normative e procedure di documentazione tecnica. L'utilizzo e la vendita di un dispositivo medico in paesi esteri richiede un adattamento alla regolamentazione del paese in questione, e i produttori che non si adeguano a tale normativa potrebbero subire il ritiro dal mercato dei loro prodotti. Linguation è a conoscenza dei requisiti di traduzione per i dispositivi medici, è per questo che collabora solo con traduttori esperti in traduzioni tecno-scientifiche con anni di esperienza nelle traduzioni per dispositivi medici.
Per garantire una maggiore sicurezza dei medical device si è ritenuto necessario rivederne la classificazione secondo due criteri. Linguation utilizza una tecnologia di traduzione assistita che contribuisce a ridurre i costi, migliorare la qualità delle traduzioni e l'esperienza del cliente. Le memorie di traduzione, ad esempio, ci permettono di sfruttare segmenti precedentemente tradotti per accelerare la consegna, garantire la coerenza terminologica e, in ultima analisi, risparmiare sui costi di traduzione. Inoltre, consentiamo di gestire facilmente i progetti di traduzione attraverso la nostra piattaforma online. Ad esempio, caricando il file da tradurre è possibile ottenere un preventivo immediato e gratuito insieme alla data di consegna.
Lo spirito del nuovo Regolamento è tutelare la salute e la sicurezza dei cittadini, per tale ragione si mira a una maggiore trasparenza delle informazioni riguardanti ciascun dispositivo medico. In primo luogo si è deciso di ampliare l’ambito di applicabilità delle regole a molti strumenti non ancora https://notes.io/w27FE . Oggi quindi sono da considerarsi dispositivi medici anche quegli strumenti che non hanno una funzione prettamente medica, come le lenti a contatto non correttive o le apparecchiature applicate alla cosmetica e gli strumenti impiegati per la prognosi e la previsione di malattie o altre condizioni di salute. Se prima ci si focalizzava sui requisiti necessari per la messa in commercio del dispositivo, adesso la norma prevede criteri e azioni più specifiche nelle fasi precedenti (valutazione clinica) e successive (sorveglianza e post commercializzazione). L’intento è intercettare a priori eventuali problematiche e, allo stesso tempo, offrire dispositivi medici sempre più avanzati.
È importante tenere in considerazione che il documento SSCP master può venire accettato in una lingua dell'UE diversa dall'inglese, a seconda degli Stati membri dell'Unione Europea in cui il dispositivo verrà venduto. In questo caso, sarà obbligatorio fornire la versione inglese entro 90 giorni dal caricamento del master nella banca dati Eudamed da parte dell'organismo notificato. In linea con la normativa GDPR, Interbrian vuole garantire che ogni utente del sito web comprenda cosa sono i cookie e per quale motivo vengono utilizzati, in modo che possa decidere consapevolmente se accettarne l’utilizzo o no. Un cookie è un piccolo file di testo contenente un numero di identificazione univoco che viene trasferito dal sito web sul disco rigido del computer attraverso un codice anonimo in grado di identificare il computer ma non l’utente e di monitorare passivamente le attività sul sito. I dati personali dell’utente che sono oggetto di trattamento per finalità di marketing (punto 3.2) saranno conservati fino fino a quando non sarà ritirato il consenso al loro trattamento per tali finalità. L’utente potrà aggiornare i dati forniti alla Società contattando la stessa all’indirizzo fornito qui di seguito.
Una traduzione di qualità per dispositivi medici non richiede solo conoscenze linguistiche e competenze tecniche. https://torp-lorentsen.hubstack.net/qual-e-il-livello-piu-alto-di-inglese-e-come-raggiungerlo-1727483350 settore dei dispositivi medici, infatti, è un'industria altamente regolamentata e i servizi di traduzione linguistica devono attenersi alle rigorose normative e procedure di documentazione tecnica. L'utilizzo e la vendita di un dispositivo medico in paesi esteri richiede un adattamento alla regolamentazione del paese in questione, e i produttori che non si adeguano a tale normativa potrebbero subire il ritiro dal mercato dei loro prodotti. Linguation è a conoscenza dei requisiti di traduzione per i dispositivi medici, è per questo che collabora solo con traduttori esperti in traduzioni tecno-scientifiche con anni di esperienza nelle traduzioni per dispositivi medici.
Per garantire una maggiore sicurezza dei medical device si è ritenuto necessario rivederne la classificazione secondo due criteri. Linguation utilizza una tecnologia di traduzione assistita che contribuisce a ridurre i costi, migliorare la qualità delle traduzioni e l'esperienza del cliente. Le memorie di traduzione, ad esempio, ci permettono di sfruttare segmenti precedentemente tradotti per accelerare la consegna, garantire la coerenza terminologica e, in ultima analisi, risparmiare sui costi di traduzione. Inoltre, consentiamo di gestire facilmente i progetti di traduzione attraverso la nostra piattaforma online. Ad esempio, caricando il file da tradurre è possibile ottenere un preventivo immediato e gratuito insieme alla data di consegna.
Lo spirito del nuovo Regolamento è tutelare la salute e la sicurezza dei cittadini, per tale ragione si mira a una maggiore trasparenza delle informazioni riguardanti ciascun dispositivo medico. In primo luogo si è deciso di ampliare l’ambito di applicabilità delle regole a molti strumenti non ancora https://notes.io/w27FE . Oggi quindi sono da considerarsi dispositivi medici anche quegli strumenti che non hanno una funzione prettamente medica, come le lenti a contatto non correttive o le apparecchiature applicate alla cosmetica e gli strumenti impiegati per la prognosi e la previsione di malattie o altre condizioni di salute. Se prima ci si focalizzava sui requisiti necessari per la messa in commercio del dispositivo, adesso la norma prevede criteri e azioni più specifiche nelle fasi precedenti (valutazione clinica) e successive (sorveglianza e post commercializzazione). L’intento è intercettare a priori eventuali problematiche e, allo stesso tempo, offrire dispositivi medici sempre più avanzati. È importante tenere in considerazione che il documento SSCP master può venire accettato in una lingua dell'UE diversa dall'inglese, a seconda degli Stati membri dell'Unione Europea in cui il dispositivo verrà venduto. In questo caso, sarà obbligatorio fornire la versione inglese entro 90 giorni dal caricamento del master nella banca dati Eudamed da parte dell'organismo notificato. In linea con la normativa GDPR, Interbrian vuole garantire che ogni utente del sito web comprenda cosa sono i cookie e per quale motivo vengono utilizzati, in modo che possa decidere consapevolmente se accettarne l’utilizzo o no. Un cookie è un piccolo file di testo contenente un numero di identificazione univoco che viene trasferito dal sito web sul disco rigido del computer attraverso un codice anonimo in grado di identificare il computer ma non l’utente e di monitorare passivamente le attività sul sito. I dati personali dell’utente che sono oggetto di trattamento per finalità di marketing (punto 3.2) saranno conservati fino fino a quando non sarà ritirato il consenso al loro trattamento per tali finalità. L’utente potrà aggiornare i dati forniti alla Società contattando la stessa all’indirizzo fornito qui di seguito.
Una traduzione di qualità per dispositivi medici non richiede solo conoscenze linguistiche e competenze tecniche. https://torp-lorentsen.hubstack.net/qual-e-il-livello-piu-alto-di-inglese-e-come-raggiungerlo-1727483350 settore dei dispositivi medici, infatti, è un'industria altamente regolamentata e i servizi di traduzione linguistica devono attenersi alle rigorose normative e procedure di documentazione tecnica. L'utilizzo e la vendita di un dispositivo medico in paesi esteri richiede un adattamento alla regolamentazione del paese in questione, e i produttori che non si adeguano a tale normativa potrebbero subire il ritiro dal mercato dei loro prodotti. Linguation è a conoscenza dei requisiti di traduzione per i dispositivi medici, è per questo che collabora solo con traduttori esperti in traduzioni tecno-scientifiche con anni di esperienza nelle traduzioni per dispositivi medici.
Per garantire una maggiore sicurezza dei medical device si è ritenuto necessario rivederne la classificazione secondo due criteri. Linguation utilizza una tecnologia di traduzione assistita che contribuisce a ridurre i costi, migliorare la qualità delle traduzioni e l'esperienza del cliente. Le memorie di traduzione, ad esempio, ci permettono di sfruttare segmenti precedentemente tradotti per accelerare la consegna, garantire la coerenza terminologica e, in ultima analisi, risparmiare sui costi di traduzione. Inoltre, consentiamo di gestire facilmente i progetti di traduzione attraverso la nostra piattaforma online. Ad esempio, caricando il file da tradurre è possibile ottenere un preventivo immediato e gratuito insieme alla data di consegna.
Lo spirito del nuovo Regolamento è tutelare la salute e la sicurezza dei cittadini, per tale ragione si mira a una maggiore trasparenza delle informazioni riguardanti ciascun dispositivo medico. In primo luogo si è deciso di ampliare l’ambito di applicabilità delle regole a molti strumenti non ancora https://notes.io/w27FE . Oggi quindi sono da considerarsi dispositivi medici anche quegli strumenti che non hanno una funzione prettamente medica, come le lenti a contatto non correttive o le apparecchiature applicate alla cosmetica e gli strumenti impiegati per la prognosi e la previsione di malattie o altre condizioni di salute. Se prima ci si focalizzava sui requisiti necessari per la messa in commercio del dispositivo, adesso la norma prevede criteri e azioni più specifiche nelle fasi precedenti (valutazione clinica) e successive (sorveglianza e post commercializzazione). L’intento è intercettare a priori eventuali problematiche e, allo stesso tempo, offrire dispositivi medici sempre più avanzati.
È importante tenere in considerazione che il documento SSCP master può venire accettato in una lingua dell'UE diversa dall'inglese, a seconda degli Stati membri dell'Unione Europea in cui il dispositivo verrà venduto. In questo caso, sarà obbligatorio fornire la versione inglese entro 90 giorni dal caricamento del master nella banca dati Eudamed da parte dell'organismo notificato. In linea con la normativa GDPR, Interbrian vuole garantire che ogni utente del sito web comprenda cosa sono i cookie e per quale motivo vengono utilizzati, in modo che possa decidere consapevolmente se accettarne l’utilizzo o no. Un cookie è un piccolo file di testo contenente un numero di identificazione univoco che viene trasferito dal sito web sul disco rigido del computer attraverso un codice anonimo in grado di identificare il computer ma non l’utente e di monitorare passivamente le attività sul sito. I dati personali dell’utente che sono oggetto di trattamento per finalità di marketing (punto 3.2) saranno conservati fino fino a quando non sarà ritirato il consenso al loro trattamento per tali finalità. L’utente potrà aggiornare i dati forniti alla Società contattando la stessa all’indirizzo fornito qui di seguito.
Una traduzione di qualità per dispositivi medici non richiede solo conoscenze linguistiche e competenze tecniche. https://torp-lorentsen.hubstack.net/qual-e-il-livello-piu-alto-di-inglese-e-come-raggiungerlo-1727483350 settore dei dispositivi medici, infatti, è un'industria altamente regolamentata e i servizi di traduzione linguistica devono attenersi alle rigorose normative e procedure di documentazione tecnica. L'utilizzo e la vendita di un dispositivo medico in paesi esteri richiede un adattamento alla regolamentazione del paese in questione, e i produttori che non si adeguano a tale normativa potrebbero subire il ritiro dal mercato dei loro prodotti. Linguation è a conoscenza dei requisiti di traduzione per i dispositivi medici, è per questo che collabora solo con traduttori esperti in traduzioni tecno-scientifiche con anni di esperienza nelle traduzioni per dispositivi medici.
Per garantire una maggiore sicurezza dei medical device si è ritenuto necessario rivederne la classificazione secondo due criteri. Linguation utilizza una tecnologia di traduzione assistita che contribuisce a ridurre i costi, migliorare la qualità delle traduzioni e l'esperienza del cliente. Le memorie di traduzione, ad esempio, ci permettono di sfruttare segmenti precedentemente tradotti per accelerare la consegna, garantire la coerenza terminologica e, in ultima analisi, risparmiare sui costi di traduzione. Inoltre, consentiamo di gestire facilmente i progetti di traduzione attraverso la nostra piattaforma online. Ad esempio, caricando il file da tradurre è possibile ottenere un preventivo immediato e gratuito insieme alla data di consegna.
Lo spirito del nuovo Regolamento è tutelare la salute e la sicurezza dei cittadini, per tale ragione si mira a una maggiore trasparenza delle informazioni riguardanti ciascun dispositivo medico. In primo luogo si è deciso di ampliare l’ambito di applicabilità delle regole a molti strumenti non ancora https://notes.io/w27FE . Oggi quindi sono da considerarsi dispositivi medici anche quegli strumenti che non hanno una funzione prettamente medica, come le lenti a contatto non correttive o le apparecchiature applicate alla cosmetica e gli strumenti impiegati per la prognosi e la previsione di malattie o altre condizioni di salute. Se prima ci si focalizzava sui requisiti necessari per la messa in commercio del dispositivo, adesso la norma prevede criteri e azioni più specifiche nelle fasi precedenti (valutazione clinica) e successive (sorveglianza e post commercializzazione). L’intento è intercettare a priori eventuali problematiche e, allo stesso tempo, offrire dispositivi medici sempre più avanzati.